
Apps como producto sanitario
Hoy en día las apps de salud pueden ser consideradas como producto sanitario o medical device. Esto implica que, según la definición del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, son herramientas con fines médicos como, por ejemplo, de diagnóstico, prevención, seguimiento, tratamiento, etc.
Para ser lanzados al mercado, todos los productos sanitarios deben disponer de certificación o marcado CE que demuestre su conformidad con los requisitos establecidos por la legislación europea. Y, ¿quién evalúa esta conformidad? Los Notify Bodies son las organizaciones encargadas de evaluar la conformidad y, por lo tanto, de garantizar la seguridad y eficacia de las apps de salud. Sin embargo, hay una gran heterogeneidad entre ellas en cuanto a conocimiento epidemiológico/clínico, lo que puede generar algunas consecuencias a la hora de evaluar adecuadamente si una app concreta en salud es segura y eficaz.
De todas maneras, actualmente, el marcado CE es la puerta de entrada para cualquier producto sanitario si quiere introducirse en el mercado o en un sistema de salud pública.
¿Cuál es la situación actual en diferentes países de Europa?
Bélgica: mHealthBelgium Initiative
En 2018, Bélgica creó una plataforma llamada mHealth Belgium Iniatitive, donde aparecen todas las apps de salud de Bélgica. Sin embargo, aunque la app aparezca en la plataforma no significa que esté aprobada. La plataforma fue implementada y gestionada por dos federaciones de industrias: por beMedTech-mD, la asociación de empresas de tecnología médica y Agorya, una asociación de compañías tecnológicas.
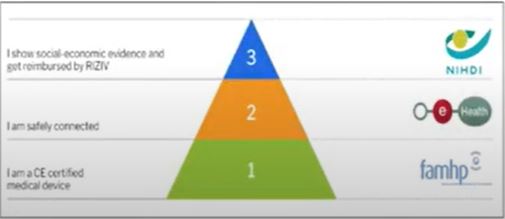
En 2020, el Departamento de Salud de Bélgica decidió generar una política de reembolso oficial para la salud digital. Es decir, decidió establecer un presupuesto definido y crear la pirámide de validación de Bélgica.
¿En qué consiste la pirámide de validación?
- La Federal Agency for Medicines and Health Products (FAMHP) evalúa (notificación voluntaria), comprueba la seguridad, calidad y eficacia de los productos sanitarios y si cumplen con la legislación EU de protección de datos.
- Si cumplen con los requisitos, pasan al segundo nivel. La organización eHealth, encargada de la infraestructura tecnológica en todo el ámbito de salud en Bélgica, revisa diferentes criterios o aspectos técnicos que las apps deben cumplir como la valoración del riesgo, la privacidad datos, la autenticación, la identificación, la relación terapéutica, el consentimiento informado o la interoperabilidad.
- Si superan el nivel 2, las apps pasan al Departamento de Salud, que evalúa la evidencia clínica y económica (real world data o estudio clínico) y deben demostrar que la app aporta valor al proceso sanitario y fuera del entorno hospitalario (holística).
Una vez se considera que una app funciona, se redefine la financiación para un proceso de atención o “el pago combinado” (bundled payment), que está entre pago por servicio (fee for service) y el capitativo (el médico recibe una cantidad fija por paciente en su lista, independientemente de la cantidad de servicios que preste a cada uno de ellos). Con la financiación, se define la indicación de la app y en qué condiciones se recetará por parte del médico.
Reino Unido
Anteriormente, en la web de la National Health Service (NHS) Library en el Reino Unido aparecían todas las apps recomendadas por el sistema nacional de salud inglés. Pero ¿qué significaba que estuviesen recomendadas? Eran apps evaluadas a través de los Digital Technology Assessment Criteria (DTAC), que brinda al personal, los pacientes y los ciudadanos la confianza de que las herramientas de salud digital que utilizan cumplen los estándares de:
- Seguridad clínica: se miran los riesgos potenciales que puede tener esa aplicación, y si existe un sistema de gestión de estos riesgos.
- Protección de datos: se asegura la protección de datos y privacidad.
- Solidez técnica: se asegura que los productos son sólidos y estables.
- Interoperabilidad: se asegura que los datos se comunican de manera exacta, rápida, segura.
- Usabilidad y accesibilidad: benchmarking de buenas prácticas con otros productos y recomendaciones de áreas de mejora.
La NHS era la encargada de llevarlo a cabo a través de grupos de expertos tanto en temas tecnológicos como en temas clínicos relacionados con la patología a la cual va dirigida esa tecnología.
Otra organización que destacar es el NICE (National Institute for Health and Care Excellence), que fue la primera institución en el Reino Unido que sacó un marco de evaluación del valor de las aplicaciones móviles. Este marco clasifica las aplicaciones según el nivel de evidencia que requiere NICE para darle su aprobación. Pero, actualmente, se está trabajando en un nuevo documento con actualizaciones (aún no es público) y ha cambiado bastante la clasificación de las apps de 2018 hasta ahora. El NICE evalúa la efectividad, el funcionamiento, el cumplimiento con estándares, el impacto y el valor añadido que aporta la app al sistema sanitario actual (si sustituye, si complementa y qué efectividad comparada o cuanto mejor es el uso de la app respecto a lo que se hace ahora).
Es importante mencionar que, tanto en el caso del DTAC y el NICE, los estudios sobre el valor de la app deben estar en hechos en el Reino Unido y que su recomendación sirve como garantía de que la app es fiable. Sin embargo, a diferencia de Bélgica, en el Reino Unido, no existe un marco presupuestario para la mHealth. Los desarrolladores de apps negocian directamente con el hospital y los grupos de clínicos para la compra de esas apps.
Alemania: DiGA
Actualmente, DiGA es la política de moda en la Unión Europea. Se trata de la ley Digital Health Care Act (Digitale-Versogugn-Gesetz, DVG) publicada por el gobierno alemán en diciembre de 2019, que permite a los médicos la “prescripción de apps”. ¿Qué tipos de apps? Todas aquellas que pasen unos criterios de inclusión y unos requisitos. Como, por ejemplo, que debe haberse probado su seguridad y eficacia (disponen de marca CE), que sean fáciles de utilizar o que aporten beneficios médicos o mejoras relevantes para el paciente en la estructura y el proceso de atención. Se incluyen las apps clasificadas como Clase I o Clase IIa según la regulación actual de productos médicos europea
Algunas de las mejoras relevantes para el paciente en la estructura y el proceso de atención incluyen la coordinación de procedimientos terapéuticos, el alineamiento de tratamientos con guías de práctica clínica y estándares reconocidos, la adherencia, la facilitación del acceso a la atención, la seguridad del paciente, la alfabetización en salud, la autonomía del paciente, la ayuda a superar las dificultades en la vida diaria debido a la enfermedad y la reducción de esfuerzos llevados a cabo por pacientes y familiares en relación con el tratamiento.
El DiGA es evaluado por la BFRA, que es el equivalente a la agencia española del medicamento, mientras que, en Bélgica, el Reino Unido y Francia lo hacen las agencias de evaluación de tecnología sanitaria.
Francia
Francia no tiene una política de evaluación de apps especifica, utiliza exactamente la misma que para otro tipo de equipos médicos. El Comité de evaluación de Tecnologías Médicas (CNEDiMTS) es el encargado de evaluar la inclusión de las apps siguiendo unos criterios de evaluación: deben aportar un beneficio clínico, deben ser eficaces y seguras, con un valor clínico añadido a lo que existe en la actualidad, con un rol en la estrategia terapéutica de la enfermedad y llevar indicaciones y uso (duración tratamiento, uso adecuado, frecuencia), especificando la población diana.
Si pasan por todo este tamiz, las apps son reembolsadas por el sistema público, aunque también existen otras fuentes de financiación como el programa experimental de telemedicina (ETAPES), que trata de dar cobertura a telemedicina con el desarrollo Evidencia para demostrar su seguridad y eficacia (programa anual) y el articulo 51 Social Security Financing Act (para innovación, eficiencia y reproductibilidad).
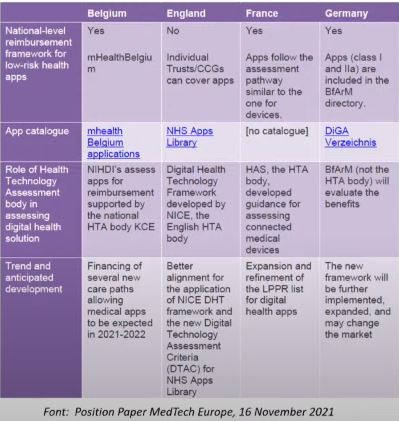
Actualmente, Francia está apostando muchísimo por la salud digital. Emmanuel Macron, presidente actual del país, y también la Unión Europea, quieren intentar implementar un DiGA francés. En la siguiente imagen, podremos encontrar una comparación de las políticas en salud digital entre los diferentes países mencionados.
*Nota: actualmente, no está disponible el catálogo NHS Apps Library.
Y, ¿en España?
Hoy por hoy no existe un presupuesto definido dentro de nuestro sistema nacional de salud para la mhealth. Así que son muchas las preguntas planteadas para una estrategia Estatal de evaluación y reembolso mHealth.
Es imprescindible que políticos, sanitarios y responsables de implementación de estas apps creen un marco para la salud digital y sigan un mapa de ruta donde se definan bien las políticas de entrada de estas tecnologías y de reembolso en nuestro país.
Referencias
- National Institute for Health and Care Excellence. Evidence Standard Framework for Digital Health Technologies. March 2019. (nice.org.uk/Media/Default/About/what-we-do/our-programmes/evidence-standards-framework/digital-evidence-standards-framework.pdf)
- MedTech Europe. Recognising the value of digital health apps: An assessment of five European health care systems. November 2021
- EIT Health Germany. DiGAS- A Model for Europe? Statements from the EIT Health Germany Round-table held as part of the 16th Kassengipfel (health-insurer summit). September 2021.

 Laura Sampietro
Laura Sampietro